Остеопластический материал BondBone
Костный цемент
О материале

BondBone™ - это новейший синтетический остеопластический материал для аугментации кости, создание которого является крупным достижением в области костной пластики в стоматологии. Он состоит из двухфазного сульфата кальция, прекрасно зарекомендовавшего себя и имеющего отличную биосовместимость, остеокондуктивность и биорезорбируемость. Двухфазный сульфат кальция обладает быстрой отверждаемостью, а его физические свойства не зависят от присутствия крови или слюны.
BondBone™ смешивается с другими гранулированными остеопластическими материалами для предотвращения миграции частиц в костном дефекте и создания композиционного аугментационного материала с превосходными характеристиками, и за счет уникального свойства сохранения формы, делает процесс применения методов аугментации максимально удобным и быстрым.

BondBone™ поставляется в виде гранулированного порошка, расфасованного в дозаторы 1 сс и 0,5 сс по 3 шприца в упаковке. Благодаря уникальному дозатору и методике имплантации, BondBone™ являет собой новый подход к реконструкции дефектов костей. У него множество преимуществ:
- Прекрасное связующее вещество. Материал является прекрасным связующим веществом для других гранулированных материалов для наращивания кости, легок в обращении и предотвращает миграцию частиц, что позволяет получить предсказуемый результат.
- Многофункциональность. В большинстве случаев BondBone™ не нужно покрывать мембраной, когда он используется сам по себе как композитный имплантат для различных дефектов. При самостоятельном использовании он идеален для полного восстановления в случае небольших дефектов (до 10 мм), если есть опора на кость хотя бы с трех сторон. Он также может использоваться в качестве мембраны на другие материалы для наращивания кости.
- Легкость в обращении. BondBone™ позволяет значительно сократить время выполнения процедуры. Исходная пластичная паста твердеет в течение 2-5 минут, что дает достаточно времени для работы.
- Адаптивность. На его схватывание не влияет присутствие крови и слюны. Чистота и безопасность BondBone™ не содержит иных компонентов, кроме сульфата кальция.
- Остеокондуктивность. Его уникальная пористая структура делает возможной инфильтрацию факторов роста через микропоры и развитие кровеносных сосудов, а также пролиферацию клеток через макропоры.
- Полное рассасывание. Он полностью рассасывается, оставляя естественную кость.
Свойства. Фаза отверждения
Процесс отверждения, длящийся около трех минут, обеспечивает врачу достаточно времени для работы. Тепло, высвобождаемое после смешивания компонентов, достигает в среднем температуры реакции 30°C (85°F) примерно через три минуты, а pH окружающей ткани остается нейтральной. Наличие в материале BondBone™ собственной фазы дигидрата приводит к ослаблению экзотермической реакции, возникающей в продуктах, в которых используются катализаторы во время отверждения. Это, в свою очередь, приводит к уменьшению дискомфорта у пациента.
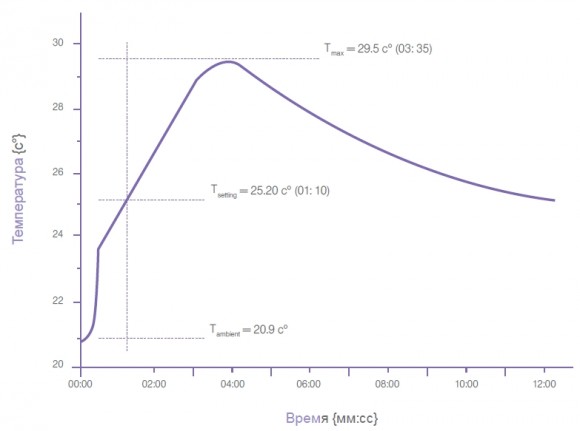
Характеристики материала. Фаза постотверждения
Морфология образующейся структуры характеризуется пористостью, составляющей около 46 процентов. Структура содержит макропоры в диапазоне значений от 300 мкм до 800 мкм, обеспечивая ангиогенез, проникновение и пролиферацию клеток, которые вызывают регенерацию костной ткани. Кроме того, микроструктура содержит микропоры в диапазоне значений от 1 мкм до 50 мкм, обеспечивая инфильтрацию факторов роста в место дефекта. Игольчатая форма частиц увеличивает прочность отвержденного материала. Состав характеризуется средней скоростью биорезорбции, соответствующей обычной скорости формирования кости, которая составляет примерно 4-10 недель.



Механизм действия
После контакта материала BondBone™ со слюной гранулированный порошок начинает активно отверждаться. Это отверждение способствует образованию на месте жесткой структуры, имеющей высокую степень кристаллизации, несмотря на влияние неблагоприятной среды (крови, белков и слюны). Чтобы сократить время отверждения , сделав материал более удобным для работы, реакцию начинают на заводе, комбинируя неотвержденные и постотвержденные частицы сульфата кальция в материале. Уникальное распределение частиц по их размерам позволяет управлять скоростью реакции и, т.е. управлять временем отверждения и созданием микроструктуры. Образующаяся микроструктура определяет высокую прочность материала и скорость резорбции, которая сопоставима со скоростью роста кости. Таким образом, BondBone™ характеризуется контролируемым, заранее заданным временем отверждения, прочностью материала и скоростью резорбции. Его можно успешно использовать в разнообразных случаях для восстановления дефектов костной ткани.
Принцип действия двухфазного сульфата кальция
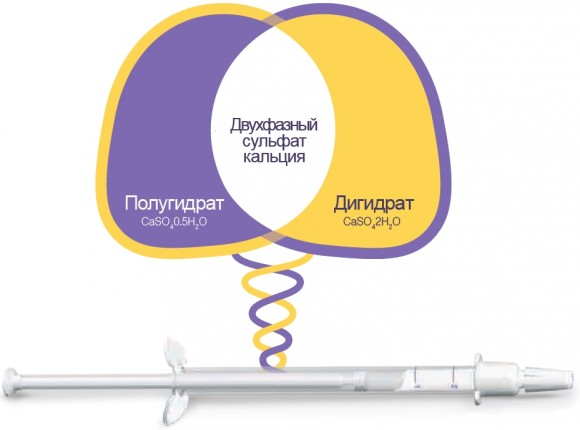
ПОЛУГИДРАТ СaSO40.5H2O:
- Пластичность.
- Отдверждаемость.
ДИГИДРАТ CaSO42H20:
- Значительная жесткость.
- Скорость резорбции примерно равна скорости роста костной ткани.
- Не зависит от наличия крови и слюны.
Инструкция:
Литеральная аугментация:
Клинические случаи:
Тейксейра К. К., Немеливски Е.
Отделение фундаментальных наук и биологии черепно-лицевого отдела,
Стоматологический колледж при Университете Нью-Йорка, Нью-Йорк;
Каркия К., Легерос Р. З.
Отделение биоматериалов и биомиметики, Стоматологический колледж при Университете Нью-Йорка, Нью-Йорк
Двухфазный кальций сульфат: каркас для дозревания хондроцитов эпифизарной пластины*
(С использованием материала BondBone, MBCP (macroporous biphasic calcium phosphate) продукт компании «MIS»)
* Данные опубликованы в «TISSUE ENGINEERING». Volume 12. Number 8. 2006.
Введение
Уже много лет костную пластику применяют для репарации дефектов, вызванных травмой или патологией. Блоки автокости (собственной кости пациента) считают «золотым стандартом» из-за их остеогенного потенциала и отсутствия отторжения. Однако, автоблоки имеют ряд недостатков, в частности, непредсказуемая степень резорбции и изменения контура, возможные осложнения со стороны донорского участка, увеличение затрат времени и денег на операцию. Блоки аллокостей (забранных у того же вида) и блоки ксенокостей (забранных у другого вида, например, бычья кость или коралл) также имеют остеогенный потенциал, но также и ряд значительных недостатков, таких как различия в свойствах и качестве кости, риск передачи заболевания, влияние на экологию (уничтожение коралловых рифов) [1, 2]. Улучшение качества биоматериалов медицинского назначения способствовало развитию синтетических костных блоков или аллопластов.
Эти материалы включают неорганические (такие как алюмина, цирконий, фосфаты кальция, сульфаты кальция, карбонат кальция, биоактивные стёкла) [3, 4] и органические или полимерные материалы (такие как коллаген, хитин, агароза, гидроксиэфиры и полилактид/ полигликолевая кислота) [5, 6].
Для индукции остеогенеза на этих каркасах факторы роста в сочетании с некоторыми биоматериалами или клетками-предшественниками. На данном этапе были попытки достичь репарации или регенерации только за счёт эндесмального формирования кости, при том, что в природе существуют два механизма скелетного развития: эндесмальный и энхондральний. Эндесмальное формирование кости предусматривает дифференциацию мезенхимальной клетки непосредственно в остеобласт, в то время как энхондральное окостенение предусматривает постепенное замещение хряща костью. Длинные кости, кости таза, хребет, основа черепа и нижняя челюсть формируются вследствие энхондрального типа [7]. Целью данного исследования является воссоздание природного процесса энхондрального формирования кости с помощью создания in vitro хрящевой пластины, которая бы после имплантации in vivo ремоделировала в кость.
Этот альтернативный метод выращивания кости с помощью тканевой инженерии имеет существенные преимущества, в частности хондроциты обладают стойкостью к низкому уровню кислорода, и эти клетки способны индуцировать васкуляризацию и остеогенез.
Мы надеемся, что кость, выращенную таким способом, невозможно будет отличить от естественной: она будет иметь те же свойства, аналогично будет реагировать на нагрузки и, что самое главное, будет иметь потенциал для роста как собственная кость пациента. Нами разработан метод выращивания эпифизарной пластинки на каркасе из кальция фосфата, а также метод индукции созревания хондроцитов и отложения ими экстрацеллюлярного матрикса.
Материалы и методы исследования
Характеристики каркаса
Использовали макропористый двухфазный кальций фосфат (MBCP®, «Biomatlante», Франция), который на 60 % состоит из гидроксиапатита и на 40 % из β-трикальций фосфата. Доказано, что пористый двухфазный кальций сульфат может быть соответствующим каркасом для замены кости [4, 11, 12]. Общая пористость MBCP составляет 70 %, с размером пор аналогичным трабекулярной кости.
Культура хондроцитов
Забор хондроцитов производили из большеберцовой кости 18-дневного куриного эмбриона, по методу Rajpurohit и соавт. [8], и выращивали в течение 1 недели. За этот период фибробласты и остеобласты (если они были в наличии) прикреплялись к чашке Петри.
Культуры, в которых было выявлено прорастание фибробластов/остео-бластов, к эксперименту не допускали. Отдельно выделены культуры хондроцитов (0,125 миллионов клеток) помещали в чашки Петри с частицами MBCP. При этом избегали посева клеток непосредственно на каркас. У этих клеток был четко определён хондроцитарный фенотип. Хондроциты выращивали непрерывно, без дальнейшего субкультивирования, в течение 3 недель при температуре 7°С и при наличии 5 % диоксида углерода. Культуры ежедневно подпитывали средой Игла в модификации Дульбекко, которая содержала 10 % Nu-сыворотки («Fisher Scientific», Fairlawn, NJ), 2 mM L-глютамина, 50 мкг/мл аскорбиновой кислоты («Sigma», St.Louis, MO) и 100 ед./мл пенициллина-стрептомицина («Cellgro», Herndon, VA). После первой недели хондроциты с частицами MBCP перенесли в новые чашки Петри и ежедневно добавляли 100 nM трансретиноловой кислоты (третиноин) в 95 % этаноле, чтобы индуцировать дозревание хондроцитов и синтез матрикса. Контрольным культурам добавляли только растворитель (95 % этанола). В конце каждой недели осуществляли забор частичек для анализа.
Солюбилизация и белковый анализ
Проводили забор хондроцитов/частичек и экстракцию клеток с помощью 0,1 % Тriton X-100 («Fisher Scientific», Fairlawn, NJ). Экстракт 6 раз смешивали в вортексмиксере от 10 до 20 с и отцентрифугировали при 2000 об./мин. Измеряли активность щелочной фосфатазы и содержание протеинов в супернатанте. Подсчёт проте-инов производили с помощью DC ProteinAssay («BioRadLaboratories», Hercules, CA) в электофотометре в соответствии с инструкцией производителя.
Активность щелочной фосфатазы (ЩФ)
Активность ЩФ измеряли по методу, описанному Leboy и соавт. [15], который основан на гидролизе нитрофенилфосфата.
Микроскопический анализ
Частички/хондроциты промывали натрий-фосфатным буфером, фик-сировали в закрепителе Камовского 4 % параформальдегиде и 5 % глютаральдегиде и обезвоживали в этаноле. После этого образцы погружали в гликольметакрилат и делали шлифы толщиной 2 мкм, которые окрашивали тулоидиновым синим и изучали под оптическим микроскопом (Nikon E 600).
Анализ сканирующей электронной микроскопии (СЭМ)
Исследуемый материал промывали натрий-фосфатным буфером и фиксировали в 2 % глютаральдегиде. Позднее частички обезвоживали при комнатной температуре за счёт погружения в градуировочные растворы этанола. Далее частицы размещали на алюминиевых пластинах с графитовым покрытием и напыляли золото-палладиевый сплав, после чего анализировали с помощью СЭМ («Jeol JSM 5400», Япония).
Окраска щелочной фосфатазы
Для окраски щелочной фосфатазы использовали раствор нафтол As-Bi фосфата. Применяли способ, описанный Iwamoto и соавт. [16]. Частицы хондроцитов/MBCP промывали натрий-фосфатным буфером, помещали в этом растворе в инкубатор на 15 минут при температуре 37°С, повторно промывали натрий-фосфатным буфером и фиксировали в 3,7 % растворе параформальдегида в натрий-фосфатном буфере.
Окрашивание альциановым синим
Частички ходроцитов/MBCP дважды промывали натрий-фосфатным буфером, после чего окрашивали его в растворе 1 % альцианового синего («Sigma», St.Louis, MO) в 3 % уксусной кислоте в течение 45 минут при комнатной температуре. После этого частички 2 минуты промывали 3 % уксусной кислотой, далее - натрий-фосфатным буфером и фиксировали в 37 % растворе параформальдегида в натрий-фосфатном буфере.
Выделение мРНК и полимеразная цепная реакция с обратной транскрипцией
Чтобы охарактеризовать профиль экспрессии генов хондроцитов, выращенных на частичках MBCP, на изолированной из 3-недельной культуры клеток мРНК была проведена полуколичественная полимеразная цепная реакция в реальном времени с обратной транскрипцией (real time RT-PCR). мРНК была изолирована с помощью набора RNeasy mini kit («Qiagen Inc.», CА) в соответствии с рекомендациями производителя. ПЛР-ЗТ была проведена с использованием праймеров, специфических к куриным генам. Коллаген І типа: вперед: GCCGTGACCTCAGACTTAGC; в обратном направлении: TTTTGTCC-TTGGGGTTCTTG; коллаген ІІ типа: вперед: ACCTCGTGGTGACAAAGGT; в обратном направлении: CATGCC-GTTAGAGCCATCTT; коллаген Х типа: вперед: AGTGCTGTCATTG-ATCTCATTGGA; в обратном направлении: TCAGAGGAATAGA-GACCATTGGATT; щелочная фосфатаза: вперед: CCTGACATC-GAGGTGATCCT; в обратном направлении: GAGACCCAGCAGG-AAGTCCA; cbfа1: вперед: CTTAGGA-GAAGTGCCCGATG; а обратном направлении: CCATCCACCGTCACC-TTTAT.
Кислый рибосомальный протеин мРНК использовали как начало для подсчёта (вперед: AACATGTTGAA-CATCTCCCC; в обратном направлении: ATCTGCAGACAGACG-CTGGC). Все праймеры были приобретены в «Qiagen Inc.». Для проведения ПЛР-ЗТ в реальном времени использовали набор QuantiTect SYBR Green RTPCR kit («Qiagen Inc.») и систему DNA Engine Optican 2 («Roche Molecular Systems», Pleasanton, CA).
Уровни транскриптов были представлены как число изменения количественных показателей (fold change) в экспрессии генов и подсчитывали с помощью порогового цикла (Ct) и формулы, приведенной ниже, где: ctl - это хондроциты, выращенные без добавления ретиноловой кислоты (РК); exp - ондроциты, на которые 2 недели воздействовали РК; а rib - это кислый рибосомальный протеин: X = 2ΔΔCt, где ΔΔCt = ΔЕ - ΔС, а ΔЕ = Сtexp - Ctrib и ΔС = Сtctl - Ctrib. Отрицательные значения ΔΔCt трактовали как увеличение, а положительные - как уменьшение экспрессии генов.
Статистический анализ
Весь эксперимент повторили 3-4 раза и определили средние показатели и стандартные ошибки. Статистически значимые отличия между тест-группами и контрольными группами определяли по тесту ANOVA. Р-показатель соответствует сравнению параметров, полученных в экспериментальной группе и соответствующей группе контроля. Статистическая значимость была установлена на уровне p<0.05.


Рис. 2. РК меняет активность щелочной фосфатазы и синтез протеогликанов. Хондроциты, взятые из большеберцовой кости, выращивали в течение 1 недели на частичках MBCP: а) в течение следующих 2 недель к питательной среде еженедельно добавляли РК; б) в группе контроля (а) в среду добавляли растворитель. Снимки частичек хондроцитов/MBCP получили после окраски в красный (для визуализации активности ЩФ) и синий (проявление уровня протеогликанов) цвет. Начальная плотность слоя клеток была одинаковой для экспериментальной и контрольной групп. Цветные фото можно просмотреть онлайн на www.lieberpub.com
Результаты
Прикрепление и пролиферация хондроцитов
СЭМ подтвердила, что хондроциты прикрепляются и пролиферируют на каркасе из МBCP (рис. 1). По завершении 1 недели хондроциты сформировали практически сплошной слой на поверхности каркаса. В течение следующих 2 недель слой стал ещё более плотным. В конце 3 недели можно было наблюдать сплошной слой полигональных хондроцитов, полностью покрывавший каркас и его поры. (рис. 1в).
Созревание хондроцитов
Применение ретиноловой кислоты привело к заметному повышению активности щелочной фосфатазы, что подтверждается глубокой красной окраской (рис. 2б, частички слева). Увеличение количества протеогликана в экстрацеллюлярном матриксе подтверждает интенсивная синяя фосфатазы также были измерены спектрофотометрически. При наличии окраски (рис. 2б, частички справа). Равные активности щелочной ретиноловой кислоты наблюдали значительное повышение фермент-ативной активности щелочной фосфатазы, что непосредственно зависело от продолжительности действия РК (рис. 3). Через 3 недели отличия между хондроцитами, на которые воздействовали и не воздействовали РК, были очевидными. При отсутствии РК клетки прикреплялись и пролиферировали в частичках MBCP®, полностью покрывая за 3 недели поверхность каркаса и его опоры (рис. 4а). Анализ СЭМ подтвердил наличие беспрерывного слоя плоских, полигональных хондроцитов на поверхности MBCP® (рис. 5а). Добавление РК в питательную среду культур приводило к отложению заметно более толстого экстрацелюлярного матрикса на поверхности частичек (рис. 4б). Изменения, вызванные добавлением РК, также были заметны на СЭМ. Рисунок 5б подтверждает, что зрелый экстрацеллюлярный матрикс полностью покрывает поверхности частичек и даже частично закрывает поры (стрелки на рис. 5б). Хондроциты окружены большим количеством волокон, образующих сложную сетку (рис. 5в). Чтобы охарактеризовать профиль экспрессии генов хондроцитов, выращенных на частичках MBCP®, на изолированной из 3-недельной культуры клеток мРНК было проведено ПЛР-ЗТ. Добавление РК в экспериментальной группе значительно увеличивало транскрипцию коллагена І типа и щелочной фосфатазы по сравнению с группой контроля. При этом увеличение транскрипции сbf1 было не таким большим (рис. 6). В то же время, уровни мРНК коллагена ІІ типа и Х типа уменьшалась при добавлении РК (рис. 6).

| Рис. 3. РК увеличила ферментативную активность ЩФ. Хондроциты, взятые из большеберцовой кости, выращивали в течение 1 недели на частичках MBCP. В течение следующих 2 недель к питательной среде добавляли или не добавляли РК (100 nM). В конце каждой недели клетки собирали для анализа и измеряли активность ЩФ с помощью спектрофотометрии. Результаты получены из 3 экспериментов. Статистически значимая разница была установлена на уровне p < 0,05 | Рис. 4. Хондроциты, выращенные на каркасе из MBCP. Хондроциты выращивали в течение 1 недели на частичках MBCP. В течение следующих 2 недель к питательной среде добавляли или не добавляли РК (100 nM). В конце 3 недели образцы фиксировали в глютаральдегиде, обезвоживали в этаноле и погружали в метилметакрилат. Шлифы обесцвечивали толуидиновым синим, изучали под микроскопом и фотографировали. При отсутствии РК (а) хондроциты сформировали тонкий непрерывный слой клеток (показан стрелкой на а). Когда к культурам добавляли РК (б), экстрацеллюлярный слой становился заметно более толстым, и можно было наблюдать гипертрофированные хондроциты (показаны стрелкой на б) |
Обсуждение
Попытки создать каркас для in vitro хряща предпринимали с целью дальнейшего использования в заместительной терапии суставных хрящей [17]. В нашем исследовании мы предлагаем создать in vitro каркас кальцифицированного хряща как материала с потенциалом роста, для замены кости. Частички MBCP® и ранее использовались как каркас для формирования кости, но клетками-пердшественниками в таких случаях выступали остеобласты [11, 18]. В то время как материалы из кальций фосфата, такие как гидроксиапатит или β-трикальций фосфат, характеризуют в основном как остеокондуктивные, но не остеоиндуктивные [19, 20], имеются данные [4, 21, 22], что некоторые пористые гидрок-сиапатиты имеют остеоиндуктивные свойства благодаря своей пористости, которая делает возможным прикрепление эндогенных костных морфогенетических протеинов (ВМР). Кроме того, макро-пористость MBCP® находится в пределах оптимальных размеров (200-400 мкм) для носителей ВМР, чтобы последние могли начать прямое формирование кости [21, 22]. Кроме того, состав MBCP и лучшая растворимость β-трикальций фосфата, чем гидроксиапатита, может также способствовать остеогенезу [23, 24]. Мы выбрали MBCP® в качестве каркаса для энхондрального формирования кости, руководствуясь данными этих и иных исследований, подтверждающих, что такие материалы способствуют прорастанию остеобластов [11, 18] и остеокластической резорбции [25].

Рис. 5. СЭМ созревающих на MBCP хондроцитов. Хондроциты выращивали в течение 1 недели, следующие 2 недели к питательной среде добавляли или не добавляли РК. В конце 3 недели образцы фиксировали, обезвоживали, напыляли слой золота, анализировали в СЭМ и фотографировали. При отсутствии РК (а) хондроциты формировали тонкий слой клеток полигональной формы. Клетки, которые выращивались с добавлением 100 nM РК (б, в), продуцировали матрикс, богатый на волокна (стрелки на в), который иногда даже закрывал поры в каркасе (стрелки на б)
Наше исследование показало, что хондроциты могут прикрепляться и пролиферировать на частичках MBCP. Чтобы определить, способны ли хондроциты, выращенные на поверхности минерала созревать, мы воздействовали на клетки РК. Добавление РК привело к увеличению экспрессии гена ЩФ и её ферментативной активности, что, согласно другим исследования [16], является важным маркером созревания. К тому же, мы наблюдали увеличение количества сbf1, которое является положительным регулятором дифференциации как остеобластов, так и хондроцитов [26, 27]. Следует отметить также то, что добавление РК уменьшало экспрессию коллагенов ІІ и Х типов и увеличивало экспремию коллагена І типа. Ранее сообщалось о том, что экспрессия генов хондроцитов эпифизарной пластины характеризуется остеобластным фенотипом [28].
Данные исследований in vivo и in vitro подтверждают, что гипертрофированные хондроциты могут дифференцироваться и далее, и выделять маркеры костных клеток [29, 30], отмечая роль хондроцитов на начальных стадиях формирования кости. По известным нам данным, мы первые сообщаем о хондроцитах, выращенных на каркасе MBCP. Ранее в исследованиях сообщали, что хондроциты суставного хряща могут прикрепляться и пролиферировать на коллагеновой губке с добавление кристаллов кальций фосфата для повышения стабильности [31], однако тогда не указывался тип хондроцитов. Другое исследование подтвердило, что хондроциты, взятые из гребня подвздошной кости кролика, выращенные на блоках гидроксиапатита, и имплантированные в костные дефекты, способствовали значительно большему увеличению отложения костной ткани, чем тогда, когда подсаживались блоки только гидроксиапатита [32]. В отличие от хондроцитов суставного хряща, наши хондроциты были забраны из эпифизарной пластины и имеют потенциал к гипертрофии и концевой дифференциации, могут модифицировать каркас и создавать, таким образом, улучшенный остеоиндуктивный материал. Даже больше, гипертрофированные клетки способны продуцировать сосудистый эндотелиальный фактор роста (VEGF), который запускает механизм реваскуляризации, необходимый для энхондрального формирования кости [9, 10]. В самом деле, когда хондроциты суставного хряща мешаные с остеобластами свода черепа, помещенные в альгинат, были имплантированы иммунодефицитной мыши, у последней наблюдалось энхондральное формирование кости.
Одновременно трансплантированные клетки развились каждая в свой тип тканей (хрящ, костно-хрящевые соединения, кость) и начали стимулировать развитие кости [33]. В то время как все эти эксперименты допускали, что клетки выделяют факторы роста/дифференциации, которые влияют на пространственное строение и активность друг друга, Gerstenfeld и соавт. подтвердил, что гипертрофированные хондроциты выделяют растворимые элементы, которые селективно способствуют остеогенезу [34]. Если целью сегодняшних исследований является выявление этих факторов и установление механизмов их действия, наш подход - представление источника факторов дифференциации, имеет большой потенциал. Наша основная задача - создать промежуточный каркас для энхондрального формирования кости с потенциалом роста.

Рис. 6. Профиль экспрессии генов созревающих хондроцитов. Хондроциты выращивали в течение 1 недели, следующие 2 недели к питательной среде добавляли или не добавляли РК. В конце 3 недели из клеток выделяли мРНК. Проводили полуколичественное ПЛР-ЗТ в реальном времени с применением праймеров специфических к генам сbf1, ЩФ, коллагену І, ІІ и Х типов. Уровень экспрессии генов был представлен как число изменения количественных показателей (fold change) между уровнями мРНК хондроцитов, выращенных с добавление РК, и хондроцитов, выращенных без добавления РК (группа контроля). Результаты были получены из 4 экспериментов. Статистически значимое отличие экспериментальной и контрольной групп было установлено на уровне p<0,05
Вывод: мы разработали метод выращивания и стимуляции созревания хондроцитов на минеральном шаблоне, MBCP. дальнейшие исследования будут посвящены установлению пригодности данного каркаса промежуточного звена для энхондрального формирования кости.
Благодарность
Исследования проводились при поддержке Фонда исследований кальция фосфата профессора L. Linkow в курсе стоматологи- ческой имплантации, Отделение биоматериалов, биомиметики, фундаментальной науки и биологии черепно-лицевого отдела Стоматологического колледжа при Университете Нью-Йорка. Авторы хотят поблагодарить Dr.R. Rohanizadeh за профессиональное сотрудничество.
Литература
1. Aichelmann-Reidy M.E. and Yukna R.A.Bone replacement grafts. The bone substitutes. - Dent. Clin. North Am. 42, 491,1998.
2. Rosenberg E. Amd Rose L.F. Biologic and clinic comsiderations for autografts and allografts in periodontal regeneration theraphy. - Dent.Clin. North Am. 42, 467, 1998.
3. Hulbert S.F., Morrisom S.J., and Klawitter J.J. Tissue reaction to three ceramics of porous and non-porous structures. - J. Biomed.Mater.Res., 6, 347, 1972.
4. LeGeros R.Z, Parsons J.R., Daculsi G., Driessens F., Lee D., Liu S.T., Metsger S., Peterson D. And Walker M. Significatiance of the porosity and physical chemistry of calcium phosphate ceramics. Biodegradationbioresorption.- Ann. NY Acad. Sci. 523, 268, 1988.
5. Burg K.J., Porter S. and Kellam J.F. Biomaterials developments for bone tissue engineering. -Biomaterials 21, 2347, 2000.
6. Lahij A., Sohrabi A. Hungerford D.S. and Frondoza C.G. Chitosan supports the expression of expression of extracellular matrix proteins in human osteoblasts and chondrocytes. - J. Biomed. Mater. Res. 51, 586, 2000.
7. Howell S.D., Dean D. The biology, chemistry andbiochemistry of the mammalian growth plate. - In:
Coe F.L., Favus M.J. eds. Disorders of Bone and Mineral Metabolism. - New York: Raven Press, 1992, pp.313-353.
8. Rajpurohit R., Koch C.J., Tao Z., Teixeira C.M. And Chapiro I.M. Adaptation of chondrosytes to low oxygen tencion: relationship between hypoxia and cellular metabolism. - J. Cell. Physiol. 168, 424, 1996.
9. Maes C., Carmeliet P., Moermans K., Stockmans I.,Smets N., Collen D., Bouilon R., Carmeliet G. Impaired angiogenesis and endochondral bone formation in mice lacking the vascular endothelial growth factor isoforms VEGF-164 and VEGF-188. - Mech. Dev. 111, 61, 2002.
10. Petersen W., Tsokos M., Pufe T. Expressin of VEGF-121 and VEGF-165 in hypertrophic chondrocytes of the human growth plate and epiphyseal cartilage.- J. Anat. 201, 153, 2002.
11. Daculci G., Passuti N., Martin S., Deudon C. Legeros R.Z., Raher S. Macroporous calcium phosphate ceramic for long bone surgery in humans and dogs. - Clinical and histological study. - J. Diomed. Mater. Res. 24, 379, 1990.
12. Nery E.B., LeGeros R.Z., Lynch K.L., Lee K. Tissue response to piphasic calcium phosphate ceramic with different ratios of HA/ beta TCP in periodontal osseous defects. - J. Periodont. 63, 729, 1992.
13. Leboy P.S., Shapiro I.M., Uschmann B.D., Oshima O., Lin D. Gene expressin on mineralizing chick epiphyseal cartilage. - J. Biol.Chem., 263 8515, 1988.
14. Kirsch T., Nah H.D., Shapiro I.M., Pacifici M.Regulated production of mineralization-competent matrix vesicles in hypertrophyc chondrocytes. - J.Cell. Biol. 137, 1149, 1997.
15. Leboy P.S., Vaias L., Uschmann B., Colub E., Adams S.L., Pasifici M. Ascorbic acid induces alkaline phosphatise, tape X collagen and calcium depositin in cultured chick chondrocytes. -J.Biol. Chem. 264, 17281, 1989.
16. Iwama to M., Yagami K., Shapiro I.M., Leboy P.S., Adams S.L., Pacifici M. Retinoic acid is a major regulator of chondrocyte maturation and matrix mineralization. - Micros. Res. Tech. 28, 483, 1994.
17. Hutmacher D.W. Scaffolds in tissue engineering bone and cartilage. - Biomaterials, 21, 2529, 2000.
18. Gauthier O., Bouler J.M., Aguado E., Pilet P., Daculsi G. Macroporous biphasic calcium phosphate ceramics: influence of macropore diameter and macroporosity percentageon bone ingrowth. -Biomaterials 19, 133, 1998.
19. Wolford L.M., Wardrop R.W., Hartog J.M. Coralline porous hydroxylapatite as a bone graft substitute in orthognatic surgary. - J. Oral Maxillofac. Surg. 45, 1034, 1987.
20. LeGeros R.Z. Properties of osteoconductive biomaterials: calcium phosphates. - Clin. Orthop. 81, 2002.
21. Reddi A.H. Morphogenesis and tissue engineering of bone and cartilage: inductive signals, stem cells and biomimetic biomaterials. - Tissue Eng., 6, 351, 2000.





 FAQ по материалу
FAQ по материалу